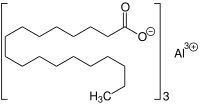
Aluminiumtristearat
| Strukturformel | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||||||
| Name | Aluminiumtristearat | |||||||||||||||||||||||||
| Andere Namen | all= Name= ID= Abruf= | opt= | cat= Wikipedia:Vorlagenfehler/Vorlage:INCI | template= Vorlage:INCI
}}{{#invoke:TemplatePar|valid|ID|2=/^[1-9]%d?%d?%d?%d?%d?%d?%d?$/ |
cat= Wikipedia:Vorlagenfehler/Vorlage:INCI | errNS= 0 | template= Vorlage:INCI
}} | |||||||||||||||||||
| Summenformel | C54H105AlO6 | |||||||||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[2] | |||||||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||||||
| Molare Masse | 877,35 g·mol−1 | |||||||||||||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||||||||||||
| Dichte |
1,01 g·cm−3[2] | |||||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||||||
Fehler im Ausdruck: Nicht erkanntes Satzzeichen „{“
Aluminiumtristearat ist eine chemische Verbindung aus der Gruppe der Aluminiumverbindungen und Fettsäuresalze (Metallseifen). Es ist das Aluminiumsalz der Stearinsäure.
Gewinnung und Darstellung
Aluminiumtristearat kann durch Reaktion von Stearinsäure mit Aluminiumhydroxid oder mit Aluminiumtriisopropylat gewonnen werden.[4]
Eigenschaften
Aluminiumtristearat ist ein weißer brennbarer Feststoff, der praktisch unlöslich in Wasser ist.[2] Die Zündtemperatur liegt bei 375 °C.[2]
Verwendung
Aluminiumstearat wird in vielen Industriezweigen als Verdickungsmittel verwendet. So wird es in Lacken, Farben, Drucktinten und Reinigungsmitteln in Suspensionen zur Viskositätserhöhung verwendet. Es wird auch als Mattierungsmittelzusatz in Farben und Lacken eingesetzt. In Gummi wird es bei der Verarbeitung verwendet, und in der Kunststoffindustrie ist es in Decklacken für beschichtete Gewebe enthalten. Es dient auch in Pulverform der Schmierung und Abdichtung sowie bei der Herstellung von Rostschutzausrüstungen und Entschäumern.[3] Weiterhin wird es zur Hydrophobierung von saugfähigen Materialien wie Papier, Textilien und Beton eingesetzt. In der Pharmazie wird es auch als Gelbildner für Oleogele und Salbengrundlagen sowie zur Viskositätserhöhung verwendet.[5][4]
Verwandte Verbindungen
- Aluminiumdistearat, C36H71AlO5 (CAS-Nr. 300-92-5 CAS-Nummer formal falsch
|all= 1= |opt= 2= KeinCASLink= |cat= Wikipedia:Vorlagenfehler/Vorlage:CASRN |template= Vorlage:CASRN }})
Einzelnachweise
- ↑ Eintrag zu ALUMINUM TRISTEARATE in der CosIng-Datenbank der EU-Kommission
- ↑ a b c d e f g h i Eintrag zu Aluminiumtristearat in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich){{#invoke:TemplatePar|valid|ZVG|2=/^[1-9]%d%d%d%d?%d?$/ |cat=Wikipedia:Vorlagenfehler/Vorlage:GESTIS |errNS=0 |template=Vorlage:GESTIS |format= |preview=1 }}{{#invoke:TemplatePar|check |all= ZVG= |opt= CAS= Name= Abruf= |cat=Wikipedia:Vorlagenfehler/Vorlage:GESTIS |errNS=0 |template=Vorlage:GESTIS |format= |preview=1 }}
- ↑ a b MP Biomedicals: Aluminum stearate[[Kategorie:Wikipedia:Defekte Weblinks/Ungeprüfte Botmarkierungen {{#invoke:Archivbot|getdate|2019-08-23 15:09:47 InternetArchiveBot}}]] (Seite nicht mehr abrufbar, festgestellt im {{#invoke:DateTime|format|2019-08|F Y}}. Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.{{#invoke:TemplatePar|check |opt = inline= url= text= datum= date= archivebot= bot= botlauf= fix-attempted= checked= |cat = Wikipedia:Vorlagenfehler/Vorlage:Toter Link |errNS = 0 |template = Vorlage:Toter Link |format = |preview = 1 }}.
- ↑ a b Arnold Willmes: Taschenbuch chemische Substanzen: Elemente – Anorganika – Organika, ISBN 978-3-8171-1787-1; S. 80.
- ↑ F. von Bruchhausen, Hermann Hager: Hagers Handbuch der pharmazeutischen Praxis, S. 149.
