Propadien
| Strukturformel | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||
| Name | Propadien | |||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||
| Summenformel | C3H4 | |||||||||||||||||||
| Kurzbeschreibung |
farbloses Gas mit süßlichem Geruch[1] | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||
| ||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||
| Molare Masse | 40,06 g·mol−1 | |||||||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||
| Siedepunkt |
−34 °C[2] | |||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[1] | |||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||
| ||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||
| ΔHf0 |
190,5 kJ·mol−1 (Gas)[4] | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||
Fehler im Ausdruck: Nicht erkanntes Satzzeichen „{“
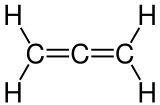
Propadien [{{#invoke:TemplatePar|check |all= 1= |opt= 2= Tondatei= |template=Vorlage:IPA |errNS= 0 |cat=Wikipedia:Vorlagenfehler/Vorlage:IPA |format=@@@ }}] ist das 1,2-Dien des Propans und somit die Stammverbindung der Allene. Der Trivialname der Verbindung lautet daher auch „Allen“. Es hat die Summenformel C3H4. Die endständigen CH2-Gruppen liegen mit dem mittleren C-Atom jeweils in einer Ebene, sind aber um 90° gegeneinander gedreht. Chemische Verbindungen, in denen eines oder mehrere Wasserstoffatome des Propadiens gegen andere Reste ausgetauscht sind, können chiral sein (Axiale Chiralität).
Gewinnung und Darstellung
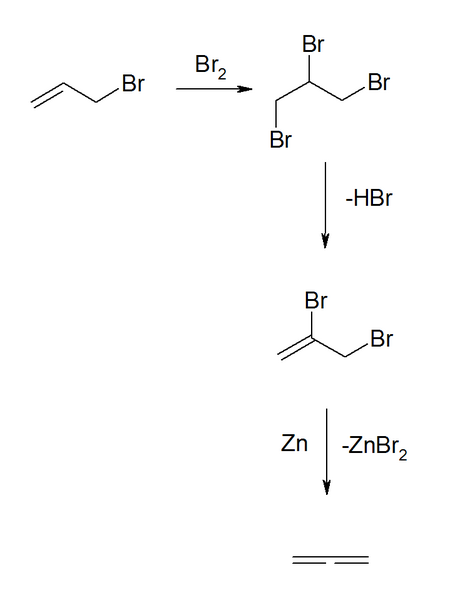
Nach einer 1888 von Gawriil Gawriilowitsch Gustawson und Nikolai Jakowlewitsch Demjanow beschriebenen Methode gelingt die Herstellung in guten Ausbeuten in einer Synthesesequenz ausgehend vom Allylbromid, welches zunächst durch Bromaddition zum 1,2,3-Tribrompropan umgewandelt wird. Eine anschließende Dehydrohalogenierung zum 2,3-Dibrompropen und Reduktion mittels Zinkpulver ergibt das Propadien.[5][6]
Die technische Herstellung erfolgt durch das Cracken von Erdölfraktionen, wobei es stets im Gemisch mit Propin anfällt.[1] Die Auftrennung der beiden Gase erfolgt durch Strippung.[7]
Eigenschaften
In Propadien ist das mittlere C-Atom sp-hybridisiert, die beiden äußeren C-Atome sind sp2-hybridisiert. Man spricht hier auch von kumulierten Doppelbindungen.
Obwohl Propadien wie das verwandte Propen Doppelbindungen hat, zeigt es nicht die typischen chemischen und physikalischen Eigenschaften der Alkene.[8] So erfolgt etwa in Gegenwart von basischen Katalysatoren eine Isomerisierung zum Propin.
- H2C=C=CH2 ⇌ H3C–C≡CH
Verwendung
Propadien wird im Gemisch mit Propin als Schweiß- und Schneidgas (MAPP-Gas) verwendet.[1] In der organischen Synthese dient es als Ausgangsstoff bei der Herstellung von Insektiziden.[1]
Siehe auch
Propin, ein Konstitutionsisomer.
Weblinks
Einzelnachweise
- ↑ a b c d e Eintrag zu Allen. In: Römpp Online. Georg Thieme Verlag
- ↑ a b c Datenblatt Allene bei Sigma-Aldrich (PDF).
- ↑ a b Eintrag zu Allen in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich){{#invoke:TemplatePar|valid|ZVG|2=/^[1-9]%d%d%d%d?%d?$/ |cat=Wikipedia:Vorlagenfehler/Vorlage:GESTIS |errNS=0 |template=Vorlage:GESTIS |format= |preview=1 }}{{#invoke:TemplatePar|valid|CAS|2=/^[1-9]%d%d?%d?%d?%d?%d?%-%d%d%-%d$/ |cat=Wikipedia:Vorlagenfehler/Vorlage:GESTIS |errNS=0 |template=Vorlage:GESTIS |format= |preview=1 }}{{#invoke:TemplatePar|check |all= ZVG= |opt= CAS= Name= Abruf= |cat=Wikipedia:Vorlagenfehler/Vorlage:GESTIS |errNS=0 |template=Vorlage:GESTIS |format= |preview=1 }}
- ↑ W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-4.
- ↑ Hauptmann/Graefe/Remane: Lehrbuch der Organischen Chemie, Deutscher Verlag der Grundstoffindustrie, Leipzig, 1980, S. 230.
- ↑ {{#invoke:Vorlage:Literatur|f}}
- ↑ Buckl, K.; Meiswinkel, A.: Propyne, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2008; {{#invoke:Vorlage:Handle|f|scheme=doi|parProblem=Problem|errCat=Wikipedia:Vorlagenfehler/Parameter:DOI|errClasses=error editoronly|errHide=1|errNS=0 4 10 100}}.
- ↑ Norbert Krause (Hrsg.), A. Stephen K. Hashmi (Hrsg.): Modern Allene Chemistry, Wiley-VCH Verlag, 2004. ISBN 978-3-527-30671-8.

